ජූලි 5 වන දින, Novo Nordisk විසින් CagriSema එන්නත් කිරීමේ III වන අදියරේ සායනික අත්හදා බැලීමක් චීනයේ දියත් කරන ලද අතර, එහි අරමුණ වන්නේ චීනයේ තරබාරු සහ අධික බර සහිත රෝගීන් සඳහා CagriSema එන්නත් කිරීමේ ආරක්ෂාව සහ කාර්යක්ෂමතාව සෙමෙග්ලුටයිඩ් සමඟ සංසන්දනය කිරීමයි.
CagriSema එන්නත් කිරීම යනු Novo Nordisk විසින් සංවර්ධනය කරන ලද දිගු ක්රියාකාරී සංයෝජන ප්රතිකාරයකි, ප්රධාන සංරචක වන්නේ GLP-1 (glucagon-like peptide-1) receptor agonist smeglutide සහ දිගු-ක්රියාකාරී ඇමයිලින් ඇනලොග් කැග්රිලින්ටයිඩ් ය.CagriSema එන්නත් කිරීම සතියකට වරක් චර්මාභ්යන්තරව පරිපාලනය කළ හැකිය.
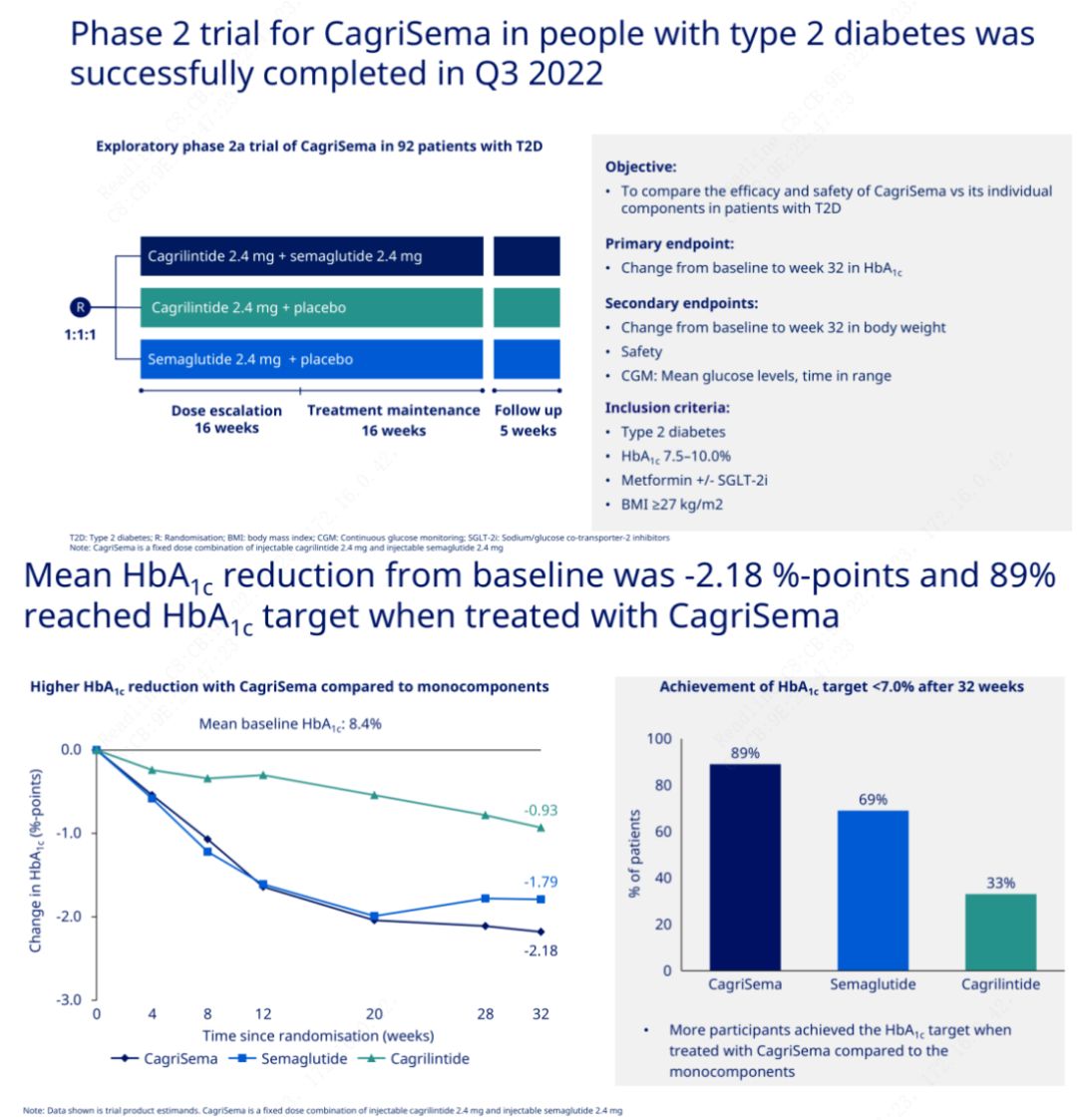
මූලික පරමාර්ථය වූයේ CagriSema (2.4 mg/2.4 mg) සතියකට වරක් චර්මාභ්යන්තරව semeglutide හෝ placebo සමඟ සංසන්දනය කිරීමයි.Novo Nordisk විසින් දෙවන අදියරේ දියවැඩියා රෝගයට ප්රතිකාර කිරීම සඳහා CagriSema අත්හදා බැලීමේ ප්රතිඵල ප්රකාශයට පත් කර ඇති අතර, CagriSema හි හයිපොග්ලයිසමික් බලපෑම සෙමෙග්ලුටයිඩ් වලට වඩා හොඳ බව ඔප්පු වූ අතර විෂයයන්ගෙන් 90% කට ආසන්න ප්රමාණයක් HbA1c ඉලක්කය සපුරා ඇත.
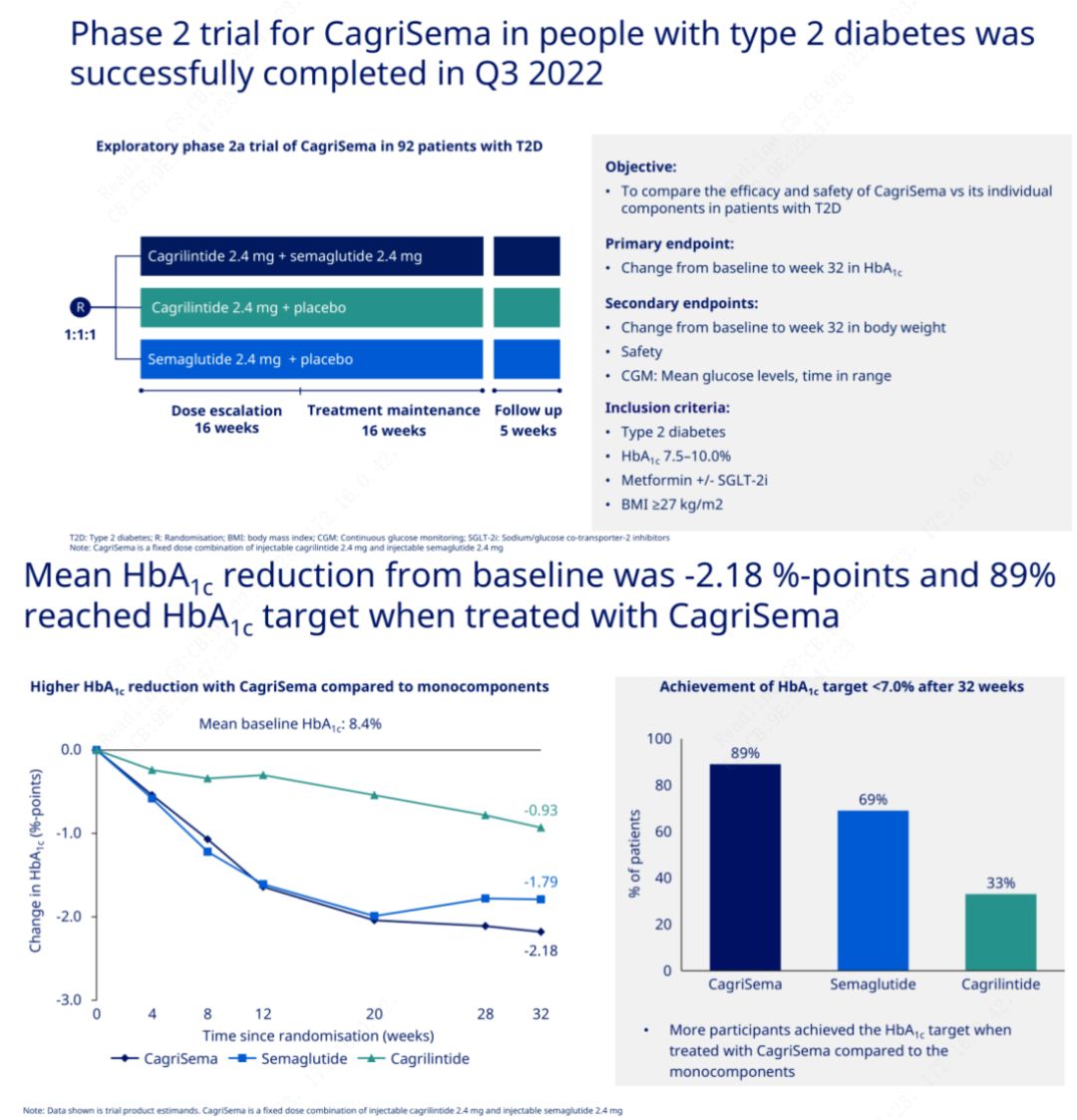
දත්ත පෙන්නුම් කළේ සැලකිය යුතු හයිපොග්ලයිසමික් ආචරණයට අමතරව, බර අඩු වීම සම්බන්ධයෙන්, CagriSema එන්නත් කිරීම සැලකිය යුතු ලෙස සෙමෙග්ලුටයිඩ් (5.1%) සහ කැග්රිලින්ටයිඩ් (8.1%) ට වඩා 15.6% ක බර අඩු වීමකි.
නව්ය ඖෂධ Tirzepatide යනු ලොව ප්රථම අනුමත සතිපතා GIP/GLP-1 receptor agonist වේ.එය සතියකට වරක් එන්නත් කරන එක් අණුවක් බවට ඉන්ක්රෙටින් දෙකක බලපෑම් ඒකාබද්ධ කරන අතර එය දෙවන වර්ගයේ දියවැඩියාව සඳහා නව ප්රතිකාර පන්තියකි.Tirzepatide 2022 මැයි මාසයේදී එක්සත් ජනපද ආහාර හා ඖෂධ පරිපාලනය (FDA) විසින් අනුමත කරන ලද අතර එය 2 වර්ගයේ දියවැඩියාව ඇති වැඩිහිටියන්ගේ ග්ලයිසමික් පාලනය (ආහාරමය පදනමක් මත සහ ව්යායාම මත) වැඩිදියුණු කිරීම සඳහා අනුමත කරන ලද අතර දැනට යුරෝපා සංගමය, ජපානය සහ අනෙකුත් රටවල අනුමත කර ඇත.
ජුලි 5 වන දින, Eli Lilly 2 වර්ගයේ දියවැඩියා රෝගීන්ට ප්රතිකාර කිරීම සඳහා ඖෂධ සායනික අත්හදා බැලීම් ලියාපදිංචි කිරීම සහ තොරතුරු අනාවරණය කිරීමේ වේදිකාව පිළිබඳ III අදියර SURPASS-CN-MONO අධ්යයනය නිවේදනය කළේය.SURPASS-CN-MONO යනු සසම්භාවී, ද්විත්ව අන්ධ, ප්ලේසෙබෝ-පාලිත අදියර III අධ්යයනයක් වන අතර එය 2 වර්ගයේ දියවැඩියාව ඇති පුද්ගලයින්ගේ ප්ලේසෙබෝ හා සසඳන විට tirzepatide monotherapy හි කාර්යක්ෂමතාව සහ ආරක්ෂාව ඇගයීම සඳහා නිර්මාණය කර ඇත.සංචාරය 1 ට පෙර දින 90 තුළ කිසිදු ප්රති-දියවැඩියා ඖෂධයක් ලබා නොගත් දෙවන වර්ගයේ දියවැඩියා රෝගීන් 200 ක් ඇතුළත් කිරීමට අධ්යයනය සැලසුම් කර ඇත (උග්ර රෝග, රෝහල්ගත කිරීම හෝ තෝරා ගැනීමේ සැත්කම් වැනි ඇතැම් සායනික තත්වයන් හැර, කෙටි කාලීන (≤14) දින) ඉන්සියුලින් භාවිතය).
දෙවන වර්ගයේ දියවැඩියාව මෙම වසරේ අනුමත කිරීමට අපේක්ෂා කෙරේ
පසුගිය මාසයේ, SURPASS-AP-Combo අධ්යයනයක ප්රතිඵල මැයි 25 වැනි දින Blockbuster ජර්නලයේ Nature Medicine හි ප්රකාශයට පත් කරන ලදී.ඉන්සියුලින් ග්ලැජින් හා සසඳන විට Tirzepatide වඩා හොඳ HbA1c සහ ආසියා-පැසිෆික් කලාපයේ (ප්රධාන වශයෙන් චීනයේ) දෙවන වර්ගයේ දියවැඩියා රෝගීන්ගේ ජනගහනයේ බර අඩුවීමක් පෙන්නුම් කරන බව ප්රතිඵල පෙන්වා දුන්නේය: HbA1c 2.49% දක්වා අඩු කිරීම සහ බර 7.2 kg දක්වා අඩු කිරීම. (9.4%) සති 40 ක ප්රතිකාරයේදී, රුධිර ලිපිඩ සහ රුධිර පීඩනයෙහි සැලකිය යුතු දියුණුවක් සහ සමස්ත ආරක්ෂාව සහ ඉවසීමේ හැකියාව යහපත් විය.
SURPASS-AP-Combo හි තුන්වන අදියර සායනික අත්හදා බැලීම පීකිං විශ්ව විද්යාලයේ මහජන රෝහලේ මහාචාර්ය ජි ලිනොං විසින් ප්රධාන වශයෙන් 2 දියවැඩියාව ඇති චීන රෝගීන් සඳහා ප්රධාන වශයෙන් සිදු කරන ලද Tirzepatide හි පළමු අධ්යයනයයි.SURPASS-AP-Combo ගෝලීය SURPASS පර්යේෂණ මාලාවේ ප්රතිඵලවලට අනුකූල වන අතර එමඟින් චීන රෝගීන්ගේ දියවැඩියා ව්යාධි විද්යාව ගෝලීය රෝගීන්ගේ ව්යාධි විද්යාවට අනුකූල වන බව තවදුරටත් සනාථ කරයි, එය නව ඖෂධ සමගාමී පර්යේෂණ හා සංවර්ධනය සඳහා පදනම වේ. චීනයේ සහ ලෝකයේ, සහ හැකි ඉක්මනින් චීනයේ දියවැඩියා ප්රතිකාර සඳහා නවතම ඖෂධ සහ ඒවායේ සායනික යෙදුම භාවිතා කිරීමට චීන රෝගීන්ට අවස්ථාව ලබා දීම සඳහා ශක්තිමත් සාක්ෂි සහාය සපයයි.
පසු කාලය: සැප්-18-2023

